PNAS:上海交通大学胡承等团队发现髓系GPSM1通过控制单核细胞和巨噬细胞的激活和趋化来调节动脉粥样硬化的进展
来源:iNature 2025-12-01 14:35
本研究证实GPSM1是动脉粥样硬化发展的调控因子,靶向GPSM1可能成为治疗动脉粥样硬化的潜在策略。
血液单核细胞的活化以及单核细胞来源的巨噬细胞向血管壁的浸润是动脉粥样硬化发生过程中的核心环节。然而,上述过程的分子机制尚不明确。本文报道了G蛋白信号调节因子1(GPSM1)在动脉粥样硬化形成中发挥关键作用。
2025年11月26日,上海交通大学胡承,Jing Yan,Feng Jiang和华中科技大学程翔共同通讯在PNAS(IF=9.4)在线发表题为Myeloid GPSM1 regulates atherosclerosis progression by governing monocyte and macrophage activation and chemotaxis的研究论文。该研究发现,在小鼠和人类动脉粥样硬化发展过程中,病灶内巨噬细胞的GPSM1表达均有所增加。髓系特异性GPSM1基因缺失可在载脂蛋白E(APOE)敲除小鼠和AAV-PCSK9注射模型中减轻小鼠的动脉粥样硬化病变,并降低主动脉炎症水平。相反,髓系限制性过表达GPSM1会加剧小鼠主动脉炎症反应,促进动脉粥样硬化的发展。
机制研究表明,GPSM1缺失通过抑制cAMP/PKA/KLF4/PMP22轴调控的p38/ERK MAPK通路,进而抑制单核细胞的趋化与黏附等活化过程,最终减轻动脉粥样硬化斑块内的促炎反应。利用负载siRNA的脂质体阻断PMP22,能够保护GPSM1过表达小鼠免受动脉粥样硬化影响。此外,一种抑制GPSM1功能的小分子化合物在体内实验中亦可抑制动脉粥样硬化的发展。综上所述,本研究证实GPSM1是动脉粥样硬化发展的调控因子,靶向GPSM1可能成为治疗动脉粥样硬化的潜在策略。
动脉粥样硬化是一种慢性炎症性疾病,也是全球心血管死亡的主要原因。其进展由单核细胞和巨噬细胞的持续募集与活化所驱动。最初,受损的内皮细胞释放如VCAM-1等黏附分子,将单核细胞募集至内膜下层;单核细胞在此摄取氧化低密度脂蛋白(oxLDL)并转化为泡沫细胞。这些细胞进一步分泌促炎因子及趋化因子,例如C–C基序趋化因子配体2(CCL2,亦称为单核细胞趋化蛋白-1,MCP-1),从而加剧活化单核细胞的浸润与血管损伤。
单核细胞与巨噬细胞可被多种刺激(如细胞因子、脂多糖、代谢应激)激活,进入趋化性与黏附能力增强的高炎症状态。该过程涉及低剂量炎症信号通过Toll样受体/核因子κB(TLR/NF-κB)及丝裂原活化蛋白激酶(MAPK)通路对细胞进行预激活,同时伴随表观遗传与代谢重编程(如组蛋白修饰、mTOR–HIF1α通路)。因此,阐明单核细胞/巨噬细胞活化与迁移的调控因子,仍是具有潜力的治疗策略。
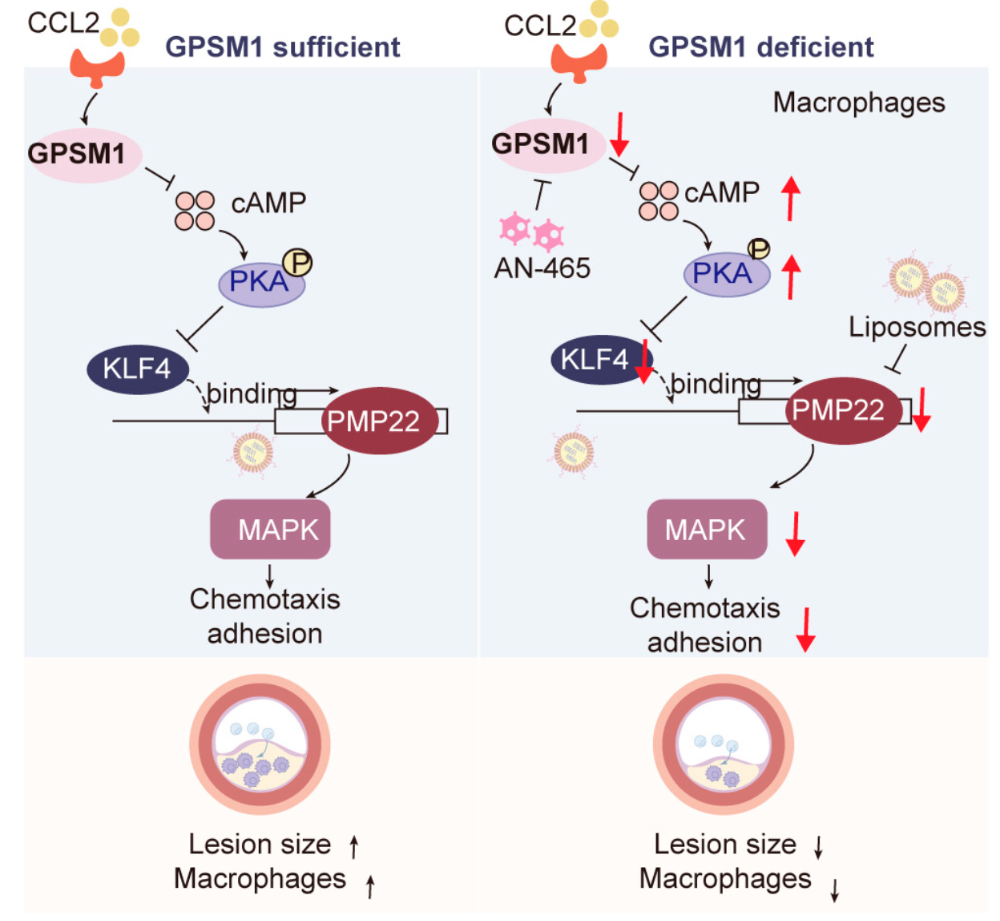
模式机理图(图片源自PNAS )
G蛋白信号调节因子1(GPSM1)作为一种鸟嘌呤核苷酸解离抑制剂,可稳定Gαi的GDP结合构象,并在免疫细胞中广泛表达。作者前期研究发现,GPSM1缺失可通过抑制脂肪组织炎症改善肥胖相关代谢紊乱,但其在动脉粥样硬化中的作用尚不明确。鉴于动脉粥样硬化属于炎症性疾病,且体外实验中GPSM1为淋巴细胞与树突状细胞迁移所必需,作者推测GPSM1可能通过调控单核细胞与巨噬细胞的趋化性影响动脉粥样硬化进程。
本研究显示,在载脂蛋白E基因敲除(Apoe−/−)背景下的髓系特异性GPSM1敲除小鼠(GPSM1LKOApoe−/−)或经AAV-PCSK9注射的GPSM1LKO小鼠,在高脂饮食(WD)条件下动脉粥样硬化病变进展减缓、坏死核心形成减少、炎症反应受到抑制;相反,髓系特异性过表达GPSM1的GPSM1TGApoe−/−小鼠则易发动脉粥样硬化。机制上,髓系GPSM1缺失通过下调MAPK信号通路,抑制单核细胞与巨噬细胞的趋化及其在主动脉壁的黏附;其中cAMP/PKA/KLF4/PMP22轴作为GPSM1的下游介质参与MAPK信号调控。值得注意的是,利用负载siRNA的脂质体沉默PMP22可保护GPSM1TG小鼠免于动脉粥样硬化发生。此外,作者发现的一种靶向GPSM1功能的小分子抑制剂能有效延缓动脉粥样硬化发展,有望成为该病的潜在治疗候选药物。
原文链接:
https://doi.org/10.1073/pnas.2517531122
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


